Alkali Tanah
 Unsur-unsur
golongan IIA disebut juga alkali tanah sebab unsur unsur tersebut
bersifat basa dan banyak ditemukan dalam mineral tanah. Logam alkali
tanah umumnya reaktif, tetapi kurang reaktif jika dibandingkan dengan logam alkali.
Unsur-unsur
golongan IIA disebut juga alkali tanah sebab unsur unsur tersebut
bersifat basa dan banyak ditemukan dalam mineral tanah. Logam alkali
tanah umumnya reaktif, tetapi kurang reaktif jika dibandingkan dengan logam alkali.Unsur–unsur logam alkali tanah

Berilium Kalsium Stronsium Barium Magnesium
1. Kelimpahan Unsur Logam Alkali Tanah
Di alam unsur-unsur alkali tanah terdapat dalam bentuk senyawa.Magnesium dan kalsium terdapat dalam batuan silikat dan aluminosilikat sebagai kationiknya. Oleh karena kation-kation dalam silikat itu larut dalam air dan terbawa oleh air hujan ke laut maka ion-ion Ca2+ dan Mg2+ banyak ditemukan di laut, terutama pada kulit kerang sebagai CaCO3. Kulit kerang dan hewan laut lainnya yang mati berakumulasi membentuk deposit batu kapur. Magnesium dalam air laut bereaksi dengan sedimen kalsium karbonat menjadi dolomit, CaCO3.MgCO3. Mineral utama berilium adalah beril, Be3Al2(SiO3)6

Mineral beril, Be3Al2(SiO3)6
mutiara dari jenis aquamarin (biru terang), dan emerald (hijau tua). Stronsium terdapat dalam celestit, SrSO4, dan stronsianat, SrCO3. Barium ditemukan dalam barit, BaSO4, dan iterit, BaCO3. Radium terdapat dalam jumlah kecil pada bijih uranium, sebagai unsur radioaktif.
2. Sifat-Sifat Unsur Logam Alkali Tanah
Kalsium, stronsium, barium, dan radium membentuk senyawa ion bermuatan +2. Magnesium kadang-kadang bersifat kovalen dan berilium lebih dominan kovalen. Sifat-sifat golongan alkali tanah ditunjukkan pada Tabel berikut

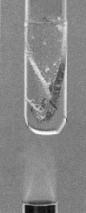
Magnesium dengan air dapat
bereaksi dalam keadaan panas.
Kekerasan logam alkali tanah berkurang dari atas ke bawah akibat kekuatan ikatan antaratom menurun. Hal ini disebabkan jarak antaratom pada logam alkali tanah bertambah panjang. Berilium merupakan logam berwarna abu dan kekerasannya mirip dengan besi, serta cukup kuat untuk menggores kaca. Logam alkali tanah yang lain umumnya berwarna perak dan lebih lunak dari berilium, tetapi lebih keras jika dibandingkan dengan logam alkali.
Titik leleh dan titik didih logam alkali menurun dari atas ke bawah dalam sistem periodik. Hal ini disebabkan oleh jari-jari atom yang bertambah panjang. Energi ionisasi kedua dari unsur-unsur golongan IIA relatif rendah sehingga mudah membentuk kation +2. Akibatnya, unsurunsur cukup reaktif. Kereaktifan logam alkali meningkat dari atas ke
bawah dalam sistem periodik. Pada suhu kamar, berilium tidak bereaksi dengan air, magnesium bereaksi agak lambat dengan air, tetapi lebih cepat dengan uap air. Adapun kalsium dan logam alkali tanah yang di bawahnya bereaksi dengan air pada suhu kamar. Reaksinya:
Ca(s) + 2H2O() ⎯⎯→Ca(OH)2(aq) + H2(g)
Logam alkali tanah bereaksi dengan oksigen membentuk oksida. Barium dapat membentuk peroksida. Barium peroksida terbentuk pada suhu rendah dan terurai menjadi oksida pada 700°C. Kalsium, stronsium, dan barium bereaksi dengan hidrogen membentuk logam hidrida. Adapun magnesium dapat bereaksi dengan hidrogen pada tekanan tinggi dengan bantuan katalis MgI2.
Ca(s) + H2(g) ⎯⎯→CaH2(s)
Mg(s) + H2(g) ⎯⎯M⎯gI2⎯→MgH2(s)
Semua unsur alkali tanah bereaksi langsung dengan halogen membentuk halida, dengan nitrogen dapat membentuk nitrida pada suhu tinggi, misalnya magnesium nitrida:
Mg(s) + N2(g)⎯⎯→Mg3N2(s)
Pembakaran unsur-unsur alkali tanah atau garamnya dalam nyala bunsen dapat memancarkan spektrum warna khas. Stronsium berwarna krimson, barium hijau-kuning, dan magnesium putih terang.
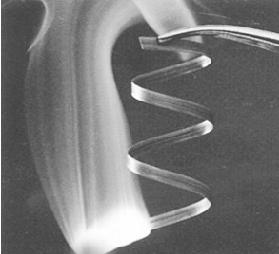
Magnesium jika dibakar akan mengeluarkan cahaya sangat terang.
Nyala logam alkali tanah
Oleh karena garam-garam alkali
tanah menghasilkan nyala beraneka
warna, sering dipakai sebagai bahan
untuk membuat kembang api.
3. Pembuatan dan Kegunaan Unsur Logam Alkali Tanah
Logam-logam alkali tanah diproduksi melalui proses elektrolisis
lelehan garam halida (biasanya klorida) atau melalui reduksi halida atau
oksida. Magnesium diproduksi melalui elektrolisis lelehan MgCl2. Air
laut mengandung sumber ion Mg2+ yang tidak pernah habis. Rumah tiram
yang banyak terdapat di laut mengandung kalsium karbonat sebagai sumber
kalsium. Pembuatan logam magnesium dari air laut telah dikembangkan oleh
berbagai industri kimia seperti ditunjukkan pada gambar berikut
Pembuatan logam magnesium dari
air laut
Jika rumah tiram dipanaskan, CaCO3 terurai membentuk oksida:CaCO3(s)⎯⎯→CaO(s) + CO2(g)
Penambahan CaO ke dalam air laut dapat mengendapkan magnesium menjadi hidroksidanya:
Mg2+(aq) + CaO(s) + H2O()⎯⎯→Mg(OH)2(s) + Ca2+(aq)
Selanjutnya, Mg(OH)2 disaring dan diolah dengan asam klorida menjadi magnesium klorida.
Mg(OH)2(s) + 2HCl(aq) ⎯⎯→MgCl2(aq) + 2H2O()
Setelah kering, garam MgCl2 dilelehkan dan dielektrolisis:
MgCl2() ⎯E⎯lek⎯troli⎯sis 1⎯.700⎯→Mg() + Cl2(g)

Kulit kerang/tiram merupakan sumber kalsium.
2Mg(s) + O2(g) ⎯⎯→2MgO(s) + Cahaya
Kalsium dibuat melalui elektrolisis lelehan CaCl2, juga dapat dibuat melalui reduksi CaO oleh aluminium dalam udara vakum. Kalsium yang dihasilkan dalam bentuk uap sehingga dapat dipisahkan.
3CaO(s) + 2Al() ⎯1⎯.200⎯⎯→3Ca(g) + Al2O3(s)
Jika logam kalsium dipadukan dengan timbel akan menghasilkan paduan yang cukup keras, digunakan sebagai elektrode pada accu. Elektrode ini tahan terhadap elektrolisis air selama proses isi-ulang, sehingga accu dapat diperbarui. Kalsium juga digunakan sebagai zat pereduksi dalam pembuatan beberapa logam yang kurang umum, seperti thorium.
ThO2(s) + 2Ca()⎯1⎯.000⎯⎯→Th(s) + 2CaO(s)
Berilium diperoleh dari elektrolisis berilium klorida, BeCl2. Natrium klorida ditambahkan untuk meningkatkan daya hantar listrik lelehan BeCl2. Selain itu, berilium juga dapat dibuat melalui reduksi garam fluoridanya oleh logam magnesium.
BeF2() + Mg()⎯9⎯50⎯C→MgF2() + Be(s)
Berilium merupakan logam mahal. Ini disebabkan manfaatnya tinggi. Jika sejumlah kecil tembaga ditambahkan ke dalam berilium, akan menghasilkan paduan yang kerasnya sama dengan baja. Adapun, barium dihasilkan melalui reduksi oksidanya oleh aluminium. Walaupun stronsium sangat sedikit digunakan secara komersial, stronsium dapat diproduksi melalui proses yang serupa.
4. Pembuatan dan Kegunaan Senyawa Alkali Tanah
Senyawa logam alkali tanah dengan beberapa aplikasinya dalam industri dan rumah tangga dipaparkan dalam Tabel berikut
Manfaat Senyawa Logam Alkali Tanah

Mineral kalsium karbonat dan kulit kerang adalah sumberkomersial sangat murah dan melimpah di alam. Jika dipanaskan hingga 900°C, karbonat terurai melepaskan karbon dioksida dan menghasilkan kalsium oksida, yang secara komersial dikenal sebagai kapur tohor. Kapur tohor digunakan pada pembuatan baja. Penambahan zat tersebut ke dalam lelehan besi yang mengandung silikat akan bereaksi dengan silikat membentuk ampas yang mengapung pada permukaan lelehan besi. Reaksinya tergolong asam-basa Lewis:
oksida basa oksida asam ampas kalsium silikat
Kalsium hidroksida, Ca(OH)2 digunakan sebagai bahan pengisi pada pembuatan kertas, dan untuk membuat gigi buatan bersama-sama senyawa fluorin. Senyawa CaO dan Ca(OH)2 digunakan untuk melunakkan air sadah. Jika air sadah yang mengandung Ca(HCO3)2 diolah dengan Ca(OH)2, semua ion kalsium diendapkan sebagai kalsium karbonat. Ca2+(aq) + 2HCO3(aq) + Ca(OH)2(aq) ⎯⎯→2CaCO3(s)+ 2H2O() Senyawa MgCO3 jika dipanaskan di atas 1.400°C, akan menjadi MgO yang bersifat agak inert. MgO digunakan untuk membuat bata tahan api (tungku pirolisis). Jika MgO dibuat pada suhu lebih sekitar 700°C, akan diperoleh serbuk oksida yang larut dalam asam dan digunakan sebagai aditif makanan hewan, merupakan sumber ion Mg2+ dalam nutrien. Senyawa penting dari barium adalah BaSO4. Senyawa ini digunakan pada penggilingan minyak dalam bentuk bubur, berfungsi sebagai perekat gurdi penggilingan. BaSO4 juga tidak dapat di tembus sinar-X sehingga senyawa ini digunakan untuk diagnosa sinar-X

Fotografi sinar-X pada usus manusia menggunakan senyawa BaSO4
Senyawa barium yang larut dalam air tidak dapat digunakan sebab
bersifat racun, tetapi suspensi BaSO4 yang terdapat sebagai ion barium,
racunnya dapat diabaikan.Daftar Kelarutan Senyawa Alkali Tanah di Dalam Air